SGS bietet Ihnen eine Medizinprodukte-Zertifizierung nach Verordnung (EU) 2017/745 über Medizinprodukte (MDR) an, informell gelegentlich auch „CE-Zertifizierung“ genannt. Unseren Service erbringen wir mit Auditoren aus Deutschland und dem europäischen Raum. Für Ihre MDR-Zertifizierung stehen Ihnen fachlich-kompetente Ansprechpartner in Deutschland zur Verfügung. Informationen über unser Zertifizierungsspektrum sowie zum Zertifizierungsprozess finden Sie auf dieser Seite.
Medizinprodukte, die in der EU in Verkehr gebracht werden, müssen den europäischen Vorschriften entsprechen und mit der CE-Kennzeichnung versehen sein.
Derzeit existieren hunderttausende verschiedene Arten von Medizinprodukten. Sie reichen von Alltagsprodukten wie Pflastern und Kontaktlinsen über MRT-Geräte bis hin zu hochmodernen chirurgischen Robotern. In der EU wurde das reibungslose Funktionieren des Binnenmarktes und die Sicherheit der Patienten durch einen gemeinsamen Rechtsrahmen sichergestellt. Medizinprodukte werden durch die Verordnung (EU) 2017/745 über Medizinprodukte (Medical Device Regulation, MDR) geregelt.
Auf dieser Seite finden Sie Informationen über die wesentlichen Anforderungen und die Gesetzgebung für Medizinprodukte in der EU sowie die Dienstleistungen, die SGS mit Ihren Benannten Stellen SGS Fimko (Notified Body 0598) und SGS Belgium (Notified Body 1639)/ anbieten kann.
Konformitätsbewertung durch eine Benannte Stelle
Wenn ein Medizinprodukt einer höheren Risikoklasse als der Klasse I angehört, muss die Konformität mit den Vorschriften durch eine Benannten Stelle bewertet werden. Seit dem Anwendungsdatum der MDR, dem 26. Mai 2021, muss die Bewertung gemäß den Regeln der MDR erfolgen.
Abhängig von der Risikoklasse gibt es verschiedene Wege der Konformitätsbewertung. Wir haben eine Infografik darüber erstellt, wie Konformitätsbewertungsverfahren gemäß MDR Artikel 52 gestaltet werden können und was bei der Vorbereitung auf die Konformitätsbewertung zu beachten ist.
Wir empfehlen, den Weg über Anhang IX - Konformitätsbewertung auf der Grundlage eines QMS (Qualitätsmanagementsystem) und der Bewertung der technischen Dokumentation - zu gehen, da die MDR ein QMS mit Mindestanforderungen für ein Medizinprodukteunternehmen vorschreibt.
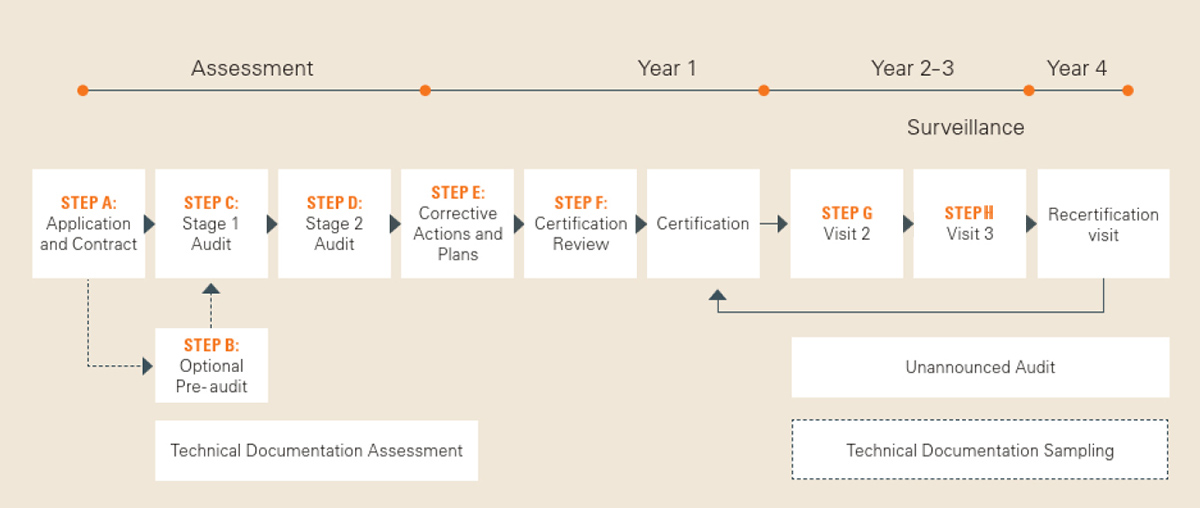
Zertifizierungsverfahren mit SGS
Beginnend mit einer Antragsprüfung umfasst das Zertifizierungsverfahren viele anspruchsvolle Schritte. In der Rubrik Downloads finden Sie unsere Broschüre „Your Certification Process Explained“, die Ihnen einen guten Überblick über die erforderlichen Schritte gibt.
Wenn Sie planen, Ihr Medizinprodukt zertifizieren zu lassen, laden Sie zunächst die Formulare für Ihre Anfrage [Link] herunter. Auch die Formulare für die Beantragung der MDR-Zertifizierung bei der Benannten Stelle SGS Fimko Oy [Link] stellen wir Ihnen hier bereit. Wenden Sie sich gerne an uns wenn Sie Fragen haben, oder um weitere Informationen zu erhalten.
Da sich Medizinprodukte und Hersteller sehr stark unterscheiden, können wir Ihnen ohne eine Antragsprüfung keine Schätzung der Durchlaufzeit oder der Kosten für das Zertifizierungsprojekt geben. Sie können sich jedoch anhand unserer MDR-Standardgebührenliste einen ersten Überblick über die anfallenden Kosten verschaffen.
Weitere Informationen
Als Rechtstext ist die MDR (EU) 2017/745 nicht immer einfach zu interpretieren. Aus diesem Grund veröffentlicht die Medical Devices Coordination Group eine Reihe von MDCG Guidance Documents.
Sie enthalten praktische Anleitungen zu verschiedenen Themen, von EUDAMED bis hin zur Interpretation von wesentlichen Änderungen. Die MDCG-Dokumente sind zwar rechtlich nicht bindend, aber sie sind eine sehr empfehlenswerte Lektüre und werden von den Benannten Stellen angewandt.
Downloads
- Formulare für Ihre Anfrage unserer Zertifizierungsleistung -> zip-Download
- Formulare für die Beantragung der MDR-Zertifizierung bei der Benannten Stelle SGS Fimko Oy -> zip-Download
- MDR Client-Technical Documentation Submission – checklist
- MDR - Meldung von QMS-Änderungen und regulatorischen Maßnahmen an SGS Fimko OY -> zip-Download
- MDR-Meldung von Produktänderungen -> zip-Download
- EU-Vigilanz-Meldung über Medizinprodukte an SGS Fimko Oy -> zip-Download
- Benennungsscope von SGS Fimko Oy
- 10 Steps to CE Mark
Merkblatt über 10 Schritte, die für die CE-Kennzeichnung eines Medizinprodukts nach MDR erforderlich sind - Konformitätsbewertungsverfahren
Eine Infografik zur Veranschaulichung der verschiedenen verfügbaren Konformitätsbewertungsverfahren nach MDR (Conformity Assessment Routes) - MDR Standard Fees List
Kosten für den Zertifizierungsprozess - Your Certification Process Explained
Dieses wichtige Dokument beschreibt den Auditprozess für die Medizinprodukte-Zertifizierung nach MDR
Ihre Ansprechpartner
Armin Hudetz
t: +49 89 78 74 75-133
E-Mail: Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein!
Customer Service Team
t: +49 89 78 74 75-222
E-Mail: Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein!